Difluoruro di diossigeno

| Difluoruro di diossigeno | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Difluoruro di diossigeno | |
| Nomi alternativi | |
| Perossido di fluoro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | O2F2 |
| Massa molecolare (u) | 69,996 g/mol |
| Aspetto | gas bruno, liquido rosso, solido giallo-arancio |
| Numero CAS | |
| PubChem | 123257 |
| SMILES | O(OF)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,45 al punto di ebollizione |
| Solubilità in acqua | decomposizione |
| Temperatura di fusione | −163 °C (110 K) |
| Temperatura di ebollizione | −57 °C (216 K) estrapolata |
| Indicazioni di sicurezza | |
| Frasi H | [1] |
Il difluoruro di diossigeno è il composto chimico di formula O2F2. È un solido arancione che fonde a −163 °C formando un liquido rosso.[2][3] O2F2 è molto meno stabile dell'altro principale fluoruro di ossigeno, OF2, ma relativamente più stabile rispetto a specie poco più che fugaci come O3F2 e O4F2.[4][5] Ha fortissime proprietà ossidanti e in parte si decompone a OF2 e ossigeno già a −160 °C (circa il 4% al giorno).
Struttura molecolare e proprietà
[modifica | modifica wikitesto]Il difluoruro di diossigeno è un composto molecolare binario di fluoro e ossigeno, lievemente endotermico (ΔHƒ° = +19,2 kJ/mol) e moderatamente endoergonico (ΔGƒ° = +58,1 kJ/mol).[6] Tuttavia, pur essendo sufficientemente stabile al di sotto del suo punto di fusione, a mano a mano che ci si avvicina al suo punto di ebollizione (-57 °C) inizia a decomporsi in fluoro e ossigeno e via via più rapidamente all'aumentare della temperatura.[7]
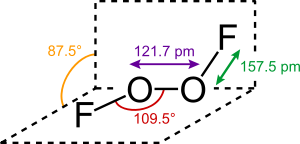
La connettività della molecola O2F2 è la stessa dei perossidi e per questo a volte viene anche detto perossido di fluoro[8] (o di difluoro).[9] Come per il perossido di idrogeno, questa molecola non planare ha simmetria C2. In essa l'ossigeno assume l'inusuale stato di ossidazione +1, mentre nella maggior parte dei suoi composti l'ossigeno ha stato di ossidazione −2.
La struttura della molecola è stata indagata nel 1962 nella regione delle microonde (spettro rotazionale)[10] e successivamente (1988) anche tramite diffrazione elettronica,[11] giungendo a risultati essenzialmente molto simili. Tale struttura assomiglia, almeno in quanto ad angoli, a quella del perossido di idrogeno, H2O2: i due atomi di fluoro assumono una posizione reciproca che è intermedia tra quella eclissata e quella sfalsata, andando a determinare un angolo diedro FOOF di poco inferiore a 90°. Questo fa sì che le polarità dei legami O-F non si cancellino: il momento dipolare risultante è di 1,44 D.[10] La distanza F-O (157,5 pm) è insolitamente grande rispetto a quella presente nel difluoruro di ossigeno OF2 (141,2 pm[12]) o anche nell'acido ipofluoroso HOF (143,45 pm[13]). La distanza O−O di 121,7 pm è invece molto più piccola di quella in H2O2, ed è, piuttosto sorprendentemente, molto simile a quella che si riscontra per il legame O=O nell'ossigeno gassoso (120,7 pm) e questo ha portato a difficoltà interpretative per la razionalizzazione della struttura di questa molecola e difficoltà nell'impostazione dei calcoli teorici su di essa, che richiedono di essere metodi ab initio di alto livello affinché si raggiunga soddisfacente accordo con i dati sperimentali.[9][11]
Nel corso degli anni ci sono state molte speculazioni per razionalizzare i motivi di una distanza O−O molto corta e di una distanza O−F molto lunga per dei legami supposti singoli. Nel 1999 è stato proposto uno schema che prevede un legame O−O di molteplicità intermedia tra 1 e 2 (stimato ≈1,6) e un legame O−F singolo ma destabilizzato e allungato a causa delle repulsioni tra i doppietti elettronici non condivisi sugli atomi di fluoro e gli orbitali molecolari π del legame O−O. Per questa molecola è stato quindi proposto che sia un ibrido di risonanza tra le seguenti principali forme limite:[14][15]
- [ F−O−O−F ←→ F− O=O+−F ←→ F−O+=O ]
Nello spettro vibrazionale la frequenza di stiramento del legame O-F cade a 630±3 cm–1, mentre in quella di O-F in OF2 cade a 928 cm–1.[16] Questo implica per il legame O-F un ordine di legame inferiore a 1.
La frequenza di stiramento di O-O si colloca a 1210 ± 3 cm–1,[17] mentre il corrispondente assorbimento in H2O2 (ordine di legame 1) consiste di una banda larga e intensa tra 845 e 875 cm–1[18] e quella in O2 (ordine di legame 2) si osserva (spettro Raman) a 2061 cm–1.[19] Questo implica per il legame O-O un ordine di legame compreso tra 1 e 2, in accordo qualitativo con i risultati dei calcoli quantomeccanici citati sopra.
Sintesi
[modifica | modifica wikitesto]Il difluoruro di diossigeno si può ottenere facendo passare una scarica elettrica di 25−30 mA a 2,1−2,4 kV attraverso una miscela di ossigeno e fluoro gassosi a bassa pressione (7−17 mmHg). Questa è sostanzialmente la procedura seguita nel 1933 da Otto Ruff, che fu il primo a sintetizzare O2F2.[2] Un'altra procedura è quella di irradiare per alcune ore con una bremsstrahlung di 3 MeV una miscela di ossigeno e fluoro liquidi a −196 °C in un recipiente di acciaio inossidabile.
- O2 + F2 → O2F2
Reattività
[modifica | modifica wikitesto]La proprietà principale di questo composto instabile è la sua fortissima capacità ossidante, che si manifesta in modo violento e spesso esplosivo anche alle temperature molto basse a cui è necessario operare (sotto −100 °C). Ad esempio esplode a contatto di acqua, alcol etilico, cloro e zolfo a temperature vicino al suo punto di fusione.[20] O2F2 converte ClF in ClF3, BrF3 in BrF5 e SF4 in SF6. Con acidi di Lewis come BF3 e PF5 cede loro uno ione fluoruro e si ottengono così i corrispondenti sali di diossigenile:[21][22]
- 2 O2F2 + 2 PF5 → 2 [O2]+[PF6]− + F2
Converte inoltre gli ossidi di uranio e plutonio nei corrispondenti esafluoruri.[23]
Note
[modifica | modifica wikitesto]- ^ Questa sostanza non è stata ancora classificata in termini di pericolosità o non è stata ancora trovata una fonte affidabile e citabile.
- ^ a b O. Ruff e W. Menzel, Neue Sauerstofffluoride: O2F2 und OF, in Z. anorg. allg. Chem., vol. 211, n. 1-2, 1933, pp. 204-208, DOI:10.1002/zaac.19332110122. URL consultato il 29 novembre 2010.
- ^ A. D. Kirshenbaum e A. V. Grosse, Ozone fluoride or trioxygen difluoride, O3F2, in J. Am. Chem. Soc., vol. 81, n. 6, 1959, pp. 1277-1279, DOI:10.1021/ja01515a003. URL consultato il 29 novembre 2010.
- ^ (EN) A. G. Streng, The Oxygen Fluorides, in Chemical Reviews, vol. 63, n. 6, 1º dicembre 1963, pp. 607–624, DOI:10.1021/cr60226a003. URL consultato il 6 luglio 2022.
- ^ (DE) A. F. Holleman, E. Wiberg e N. Wiberg, XII. Die Gruppe der Halogene, in Anorganische Chemie, 103ª ed., DE GRUYTER, 2017, p. 532, ISBN 978-3-11-026932-1.
- ^ John L. Lyman, Thermodynamic Properties of Dioxygen Difluoride (O2F2) and Dioxygen Fluoride (O2F), in Journal of Physical and Chemical Reference Data, vol. 18, n. 2, 1989-04, pp. 799–807, DOI:10.1063/1.555830. URL consultato il 6 luglio 2022.
- ^ (EN) A. G. Streng, The Chemical Properties of Dioxygen Difluoride, in Journal of the American Chemical Society, vol. 85, n. 10, 1963-05, pp. 1380–1385, DOI:10.1021/ja00893a004. URL consultato il 6 luglio 2022.
- ^ (EN) K. R. Loos, C. T. Goetschel e V. A. Campanile, Vibrational spectrum and structure of fluorine peroxide O2F2, in Chemical Communications (London), n. 24, 1968, pp. 1633, DOI:10.1039/c19680001633. URL consultato il 5 maggio 2022.
- ^ a b (EN) Olfa Ferchichi, Alexander Alijah e Thibaud Cours, Accurate theoretical characterization of dioxygen difluoride: a problem resolved, in Physical Chemistry Chemical Physics, vol. 20, n. 17, 2018, pp. 11826–11832, DOI:10.1039/C7CP08659H. URL consultato il 5 maggio 2022.
- ^ a b (EN) Robert H. Jackson, 884. The microwave spectrum, structure, and dipole moment of dioxygen difluoride, in Journal of the Chemical Society (Resumed), 1962, pp. 4585, DOI:10.1039/jr9620004585. URL consultato il 5 maggio 2022.
- ^ a b (EN) Lise Hedberg, Kenneth Hedberg e P. G. Eller, Dioxygen difluoride: electron diffraction investigation of the molecular structure in the gas, in Inorganic Chemistry, vol. 27, n. 2, 1988-01, pp. 232–235, DOI:10.1021/ic00275a004. URL consultato il 5 maggio 2022.
- ^ (EN) Louis Pierce, Nicholas Di Cianni e Robert H. Jackson, Centrifugal Distortion Effects in Asymmetric Rotor Molecules. I. Quadratic Potential Constants and Average Structure of Oxygen Difluoride from the Ground‐State Rotational Spectrum, in The Journal of Chemical Physics, vol. 38, n. 3, 1963-02, pp. 730–739, DOI:10.1063/1.1733730. URL consultato il 6 luglio 2022.
- ^ (EN) Filip Pawłowski, Poul Jørgensen e Jeppe Olsen, Molecular equilibrium structures from experimental rotational constants and calculated vibration–rotation interaction constants, in The Journal of Chemical Physics, vol. 116, n. 15, 15 aprile 2002, pp. 6482–6496, DOI:10.1063/1.1459782. URL consultato il 5 luglio 2022.
- ^ A. J. Bridgeman e J. Rothery, Bonding in mixed halogen and hydrogen peroxides, in J. Chem. Soc., Dalton Trans., 1999, pp. 4077-4082, DOI:10.1039/A904968A. URL consultato il 29 novembre 2010.
- ^ (DE) Erwin Riedel e Christoph Janiak, Anorganische Chemie, 9ª ed., De Gruyter, 2015, p. 446, ISBN 978-3-11-035526-0.
- ^ T. Shimanouchi, Tables of Molecular Vibrational Frequencies Consolidated Volume I, 1972, pp. 1–160. URL consultato il 6 maggio 2022.
- ^ (EN) K. C. Kim e G. M. Campbell, The infrared spectrum and vibrational intensity of gaseous dioxygen difluoride (foof), in Journal of Molecular Structure, vol. 129, n. 3, 1º luglio 1985, pp. 263–270, DOI:10.1016/0022-2860(85)80170-8. URL consultato il 6 maggio 2022.
- ^ (EN) V. Vacque, B. Sombret e J.P. Huvenne, Characterisation of the O-O peroxide bond by vibrational spectroscopy, in Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, vol. 53, n. 1, 1997-01, pp. 55–66, DOI:10.1016/S1386-1425(97)83009-0. URL consultato il 6 maggio 2022.
- ^ Vibrational Modes of Oxygen, su chem.purdue.edu. URL consultato il 6 maggio 2022.
- ^ A. G. Streng, The chemical properties of dioxygen difluoride, in J. Am. Chem. Soc., vol. 85, n. 10, 1963, pp. 1380–1385, DOI:10.1021/ja00893a004. URL consultato il 29 novembre 2010.
- ^ I. J. Solomon, R. I. Brabets, R. K. Uenishi, J. N. Keith, e J. M. McDonough, New dioxygenyl compounds, in Inorg. Chem., vol. 3, n. 3, 1964, p. 457, DOI:10.1021/ic50013a036. URL consultato il 29 novembre 2010.
- ^ A. F. Holleman e A. F. Wiberg, Inorganic Chemistry, Academic Press, 2001, ISBN 0-12-352651-5.
- ^ D. A. Atwood, Fluorine: Inorganic chemistry. In Encyclopedia of Inorganic Chemistry, John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia076.
Bibliografia
[modifica | modifica wikitesto]- N. N. Greenwood, A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Difluoruro di diossigeno
Wikimedia Commons contiene immagini o altri file su Difluoruro di diossigeno