Neopentan
 Vikipedi, özgür ansiklopedi
Vikipedi, özgür ansiklopedi
 | |||
 | |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Tercih edilen IUPAC adı 2,2-Dimetilpropan[1] | |||
Diğer adlar Neopentan Tetrametilmetan[2] | |||
| Tanımlayıcılar | |||
3D model (JSmol) | |||
| 1730722 | |||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.006.677 | ||
| EC Numarası |
| ||
| 1850 | |||
| MeSH | neopentane | ||
PubChem CID | |||
| UNII | |||
| UN numarası | 2044 | ||
CompTox Bilgi Panosu (EPA) | |||
| |||
| Özellikler | |||
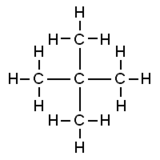
| Kimyasal formül | C5H12 | ||
| Molekül kütlesi | 72,15 g mol−1 | ||
| Görünüm | renksiz gaz | ||
| Koku | kokusuz | ||
| Yoğunluk | 3.255 kg/m3 (gas, 9.5 °C) 601.172 kg/m3 (liquid, 9.5 °C) | ||
| Erime noktası | -165 °C (-265 °F; 108 K) | ||
| Kaynama noktası | 95 °C (203 °F; 368 K) | ||
| Buhar basıncı | 146 kPa (at 20 °C)[3] | ||
Henry yasası sabiti (kH) | 4.7 nmol Pa−1 kg−1 | ||
| Termokimya | |||
Isı sığası (C) | 121.07–120.57 J K−1 mol−1 | ||
Standart molar entropi (S⦵298) | 217 J K−1 mol−1 | ||
Standart formasyon entalpisi (ΔfH⦵298) | −168.5–−167.3 kJ mol−1 | ||
Standart yanma entalpisi (ΔcH⦵298) | −3.51506–−3.51314 MJ mol−1 | ||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| Piktogramlar |   | ||
| İşaret sözcüğü | Danger | ||
| Tehlike ifadeleri | H220, H411 | ||
| Önlem ifadeleri | P210, P273, P377, P381, P391, P403, P501 | ||
| NFPA 704 (yangın karosu) | |||
| Benzeyen bileşikler | |||
Benzeyen alkanlar | |||
Benzeyen bileşikler | |||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |||
| Bilgi kutusu kaynakları | |||
2,2-dimetilpropan olarak da adlandırılan neopentan, beş karbon atomlu çift dallı zincirli bir alkandır. Neopentan, oda sıcaklığında ve basıncında yanıcı bir gazdır, soğuk bir günde, bir buz banyosunda veya daha yüksek bir basınca sıkıştırıldığında oldukça uçucu bir sıvıya dönüşebilir.
Neopentan, dördüncül karbona sahip en basit alkandır ve akiral tetrahedral simetriye sahiptir. Moleküler formülü C5H12(pentan) olan üç yapısal izomerden biridir, diğer ikisi n-pentan ve izopentandır. Bu üçünden standart şartlarda gaz olan tek moleküldür; diğerleri sıvıdır.
İsimlendirme[değiştir | kaynağı değiştir]
Geleneksel isim neopentan 1993 IUPAC önerilerinde hala korunmuştur,[4][5] ancak 2013 önerilerine göre artık önerilmemektedir. Tercih edilen IUPAC adı, sistematik ad olan 2,2-dimetilpropandır, ancak ornatık sayıları gereksizdir çünkü tek olası formül “dimetilpropan” dır.

Bir neopentil ikame örneği için - genellikle "Np" ile simgelenen, yapı Me3CCH2 yer alır , neopentil alkol (Me3CCH2OH veya NpOH). Np ayrıca neptunyum elementini (atom numarası 93) sembolize ettiğinden, bu kısaltmayı dikkatle kullanmalıdır.
Eski isim tetrametilmetan da özellikle eski kaynaklarda kullanılır.[6][7]
Fiziksel ozellikleri[değiştir | kaynağı değiştir]
Kaynama ve erime noktaları[değiştir | kaynağı değiştir]
Neopentanın kaynama noktası sadece 9.5 °C'dir, izopentandan (27.7 °C) ve normal pentandan (36.0 °C) ciddi ölçüde düşüktür. Bu nedenle, neopentan oda sıcaklığında ve atmosferik basınçta bir gazdır, diğer iki izomer ise (zar zor) sıvıdır.
Neopentanın erime noktası (−16.6 °C)'dır, izopentandan (−159.9 °C) 140 derece ve n- pentandan (-129.8 °C) 110 derece daha yüksektir. Bu anormallik, tetrahedral neopentan molekülü ile mümkün olduğu varsayılan daha iyi katı hal paketlemesine atfedilmiştir; ancak bu açıklamaya, diğer iki izomerden daha düşük bir yoğunluğa sahip olması nedeniyle itiraz edilmiştir. Dahası, füzyon entalpisi, hem n- pentan hem de izopentanın füzyon entalpisinden daha düşüktür, dolayısıyla yüksek erime noktasının, daha yüksek moleküler simetriden kaynaklanan bir entropi etkisinden kaynaklandığını gösterir. Gerçekte, neopentanın füzyon entropisi, n- pentan ve izopentanınkinden yaklaşık 4 kat daha düşüktür.[8]
¹H NMR spektrumu[değiştir | kaynağı değiştir]
Neopentanın tam dört yüzlü simetrisi nedeniyle, tüm protonlar kimyasal olarak eşdeğerdir ve karbon tetraklorür içinde çözüldüğünde tek bir NMR kimyasal kaymasına = 0.902 yol açar.[9] Bu bakımdan neopentan, tek kimyasal kayması geleneksel olarak sıfır olan silan analoğu tetrametilsilana benzer.
Neopentan molekülünün simetrisi, bazı hidrojen atomları döteryum atomları ile değiştirilirse bozulabilir. Özellikle, her bir metil grubu farklı sayıda ikame edilmiş atoma (0, 1, 2 ve 3) sahipse, bir kiral molekül elde edilir. Bu durumda kiralite, yalnızca çekirdeklerinin kütle dağılımından kaynaklanırken, elektron dağılımı hala esasen akiraldir.[10]
Kaynakça[değiştir | kaynağı değiştir]
- ^ "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. s. 652. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ Aston, J.G.; Messerly, G.H., Heat Capacities and Entropies of Organic Compounds II. Thermal and Vapor Pressure Data for Tetramethylmethane from 13.22K to the Boiling Point. The Entropy from its Raman Spectrum, J. Am. Chem. Soc., 1936, 58, 2354.
- ^ "Neopentane | C5H12 - PubChem". 2 Ekim 2015 tarihinde kaynağından arşivlendi.
- ^ "Table 19(a) Acyclic and monocyclic hydrocarbons. Parent hydrocarbons". 22 Nisan 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Eylül 2020.
- ^ A Guide to IUPAC Nomenclature of Organic Compounds 1993. Oxford: Blackwell Science. 1994. ISBN 978-0-632-03488-8.
- ^ Whitmore (1 Eylül 1934). "Preparation of Tetramethylmethane (Neopentane) and Determination of its Physical Constants1". Journal of the American Chemical Society. 55 (9): 3803-3806.
- ^ LaCoste (15 Ekim 1934). "The Rotational Wave Equation of Tetramethylmethane for Zero Potential and a Generalization". Physical Review. 46 (8): 718-724.
- ^ Wei (1999). "Molecular Symmetry, Rotational Entropy, and Elevated Melting Points". Ind. Eng. Chem. Res. 38 (12): 5019-5027. doi:10.1021/ie990588m.
- ^ Spectral Database for Organic Compounds, Proton NMR spectrum of neopentane 14 Nisan 2020 tarihinde Wayback Machine sitesinde arşivlendi., accessed 4 Jun 2018.
- ^ Haesler (2007). "Absolute configuration of chirally deuterated neopentane" (PDF). Nature. 446 (7135): 526-529. doi:10.1038/nature05653. PMID 17392783. 15 Ağustos 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 13 Eylül 2020.
Dış bağlantılar[değiştir | kaynağı değiştir]
- Linstrom, Peter
- IUPAC Organik Kimya İsimlendirmesi (8 Haziran 2011 tarihinde Wayback Machine sitesinde arşivlendi. " Mavi Kitap " ın online versiyonu)