Iodato di sodio

| Iodato di sodio | |
|---|---|
 | |
| Caratteristiche generali | |
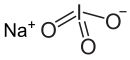
| Formula bruta o molecolare | NaIO3 |
| Massa molecolare (u) | 197,89 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 231-672-5 |
| PubChem | 23675764 |
| SMILES | [O-]I(=O)=O.[Na+] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | ~ 4,28 (20 °C) |
| Solubilità in acqua | ca. 19 g/l (20 °C) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   | |
| pericolo | |
| Frasi H | 272 - 302 - 317 - 334 |
| Consigli P | 220 - 261 - 280 - 342+311 [1] |
Lo iodato di sodio è il sale di sodio dell'acido iodico.
A temperatura ambiente si presenta come un solido bianco inodore.
Esso è un agente ossidante e in quanto tale può sviluppare fiamme a contatto con combustibili e agenti riducenti.
Reazioni
[modifica | modifica wikitesto]Lo Iodato di Sodio può essere ossidato a meta-periodato di Sodio facendolo reagire con Ipoclorito di Sodio:
NaIO3 + NaOCl → NaIO4 + NaCl
Lo Iodato di Sodio anidro si decompone a temperature superiori ai 500 °C secondo la seguente reazione:
2NaIO3 → 2NaI + 3O2
Sintesi
[modifica | modifica wikitesto]Lo iodato di sodio si può sintetizzare a partire dall'Acido Iodico e dall'Idrossido di Sodio,secondo la seguente reazione:
HIO3 + NaOH → NaIO3 + H2O
Può anche essere preparato a partire da Iodio e Idrossido di Sodio in Etanolo,in quanto esso precipita:,in soluzione rimane lo Ioduro di Sodio:
3 I2 + 6 NaOH → NaIO3 + 5 NaI + 3 H2O
Non precipita tutto lo Iodato di Sodio prodotto perché parte di questo viene solubilizzato dall'Acqua prodotta dalla reazione stessa.
Sicurezza
[modifica | modifica wikitesto]Materiali incompatibili:
Agenti fortemente riducenti, Metalli in polvere, Incompatibilità: miscele di iodati con alluminio, arsenico, rame, carbonio, fosforo (rosso e bianco) e zolfo in forma di polvere fine; idruri di alcali e metalli alcalinoterrosi; solfuri di antimonio, arsenico, rame o stagno, cianuri metallici, tiocianati o biossido di manganese impuro possono reagire violentemente o con esplosione, sia spontaneamente (in particolare in presenza di umidità), sia in seguito a riscaldamento, frizione, urti, scintille o per addizione di acido solforico.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. dell'11.09.2011
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Iodato di sodio
Wikimedia Commons contiene immagini o altri file su Iodato di sodio