அந்திமனி

| |||||||||||||||||||||||||
| பொது | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| பெயர், குறி எழுத்து, தனிம எண் | ஆண்டிமனி, Sb, 51 | ||||||||||||||||||||||||
| வேதியியல் பொருள் வரிசை | உலோகப்போலி | ||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, வலயம் | 15, 5, p | ||||||||||||||||||||||||
| தோற்றம் | பளபளப்பான வெண்சாம்பல்  | ||||||||||||||||||||||||
| அணு நிறை (அணுத்திணிவு) | 121.760(1) g/mol | ||||||||||||||||||||||||
| எதிர்மின்னி அமைப்பு | [Kr] 4d10 5s2 5p3 | ||||||||||||||||||||||||
| சுற்றுப் பாதையிலுள்ள எதிர்மின்னிகள் (எலக்ட்ரான்கள்) | 2, 8, 18, 18, 5 | ||||||||||||||||||||||||
| இயல்பியல் பண்புகள் | |||||||||||||||||||||||||
| இயல் நிலை | திண்மம் | ||||||||||||||||||||||||
| அடர்த்தி (அறை வெ.நி அருகில்) | 6.697 கி/செ.மி³ | ||||||||||||||||||||||||
| உருகுநிலையில் நீர்மத்தின் அடர்த்தி | 6.53 g/cm³ | ||||||||||||||||||||||||
| உருகு வெப்பநிலை | 903.78 K (630.63 °C, 1167.13 °F) | ||||||||||||||||||||||||
| கொதி நிலை | 1860 K (1587 °C, 2889 °F) | ||||||||||||||||||||||||
| நிலை மாறும் மறை வெப்பம் | 19.79 கி.ஜூ/மோல் (kJ/mol) | ||||||||||||||||||||||||
| வளிமமாகும் வெப்ப ஆற்றல் | 193.43 கி.ஜூ/மோல் | ||||||||||||||||||||||||
| வெப்பக் கொண்மை | (25 °C) 25.23 ஜூ/(மோல்·K) J/(mol·K) | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||
| படிக அமைப்பு | முச்சரி பருமச்செவ்வகம் rhombohedral | ||||||||||||||||||||||||
| ஆக்சைடு நிலைகள் | −3, 3, 5 | ||||||||||||||||||||||||
| எதிர்மின்னியீர்ப்பு | 2.05 (பௌலிங் அளவீடு) | ||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் | 1st: 834 kJ/(mol | ||||||||||||||||||||||||
| 2nd: 1594.9 kJ/mol | |||||||||||||||||||||||||
| 3rd: 2440 kJ/mol | |||||||||||||||||||||||||
| அணு ஆரம் | 145 பிமீ | ||||||||||||||||||||||||
| அணுவின் ஆரம் (கணித்) | 133 pm | ||||||||||||||||||||||||
| கூட்டிணைப்பு ஆரம் | 138 pm | ||||||||||||||||||||||||
| வேறு பல பண்புகள் | |||||||||||||||||||||||||
| காந்த வகை | no data | ||||||||||||||||||||||||
| மின் தடைமை | (20 °C) 417 nΩ·m | ||||||||||||||||||||||||
| வெப்பக் கடத்துமை | (300 K) 24.4 வாட்/(மீ·கெ) W/(m·K) | ||||||||||||||||||||||||
| வெப்ப நீட்சி | (25 °C) 11.0 மைக்.மீ/(மி.மீ·கெ) µm/(m·K) | ||||||||||||||||||||||||
| ஒலியின் விரைவு (மெல்லிய கம்பி வடிவில்) | (20 °C) 3420 மீ/நொடி | ||||||||||||||||||||||||
| யங்கின் மட்டு | 55 GPa | ||||||||||||||||||||||||
| Shear modulus | 20 GPa | ||||||||||||||||||||||||
| அமுங்குமை | 42 GPa | ||||||||||||||||||||||||
| மோவின்(Moh's) உறுதி எண் | 3.0 | ||||||||||||||||||||||||
| பிரிநெல் உறுதிஎண் Brinell hardness]] | 294 MPa (மெகாபாஸ்) | ||||||||||||||||||||||||
| CAS பதிவெண் | 7440-36-0 | ||||||||||||||||||||||||
| குறிபிடத்தக்க ஓரிடத்தான்கள் | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| மேற்கோள்கள் | |||||||||||||||||||||||||
ஆண்டிமனி (Antimony) என்பது Sb என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு வேதியியல் தனிமம் ஆகும். அந்திமனி என்ற பெயராலும் அழைக்கப்படும் இத்தனிமத்தின் அணு எண் 51 மற்றும் அணு எடை 71 ஆகும். ஆண்டிமனி பளபளப்பான சாம்பல் நிறமுடைய ஒரு உலோகப் போலியாகும். இயற்கையில் இது சிடிப்னைட்டு (Sb2S3) எனப்படும் சல்பைடு கனிமமாகக் காணப்படுகிறது. பண்டைய காலத்திலிருந்தே ஆண்டிமனி தனிமத்தின் சேர்மங்கள் அறியப்பட்டிருக்கின்றன, அவை பெரும்பாலும் தூளாக்கப்பட்டு மருந்து மற்றும் ஒப்பனைப் பொருட்களாக கோகல் என்ற அரபு மொழிப் பெயரில் பயன்படுத்தப்பட்டன [1] உலோக ஆண்டிமனி குறித்த செய்திகளும் அறியப்படுகின்றன. ஆனால் ஆண்டிமனி கண்டறியப்பட்ட தொடக்கக் காலத்தில் இது தவறுதலாக ஈயம் என்ற தனிமமாகப் பார்க்கப்பட்டது. மேற்கத்திய நாடுகளில் 1540 ஆம் ஆண்டில் ஆண்டிமனி பற்றிய விவரங்கள் வானோக்கியோ பிரிங்கியுக்கியோ என்ற உலோகவியலாளரால் எழுதப்பட்டுள்ளது.
சில காலம் சீனா ஆண்டிமனி மற்றும் அதன் சேர்மங்கள் உற்பத்தியில் மிகப்பெரிய உற்பத்தியாளராக இருந்து வந்தது. பெரும்பாலான உற்பத்தி ஊனானில் இருக்கும் சிக்குவான்சான் சுரங்கத்திலிருந்து கிடைத்தது. சிடிப்னைட்டு கனிமத்தை வறுத்தல் மற்றும் அதனுடன் கார்பன் அல்லது இரும்புடன் நேரடியாகச் சேர்த்து ஒடுக்குதல் செயல்முறைகளால் ஆண்டிமனியை தயாரித்தல் மற்றும் சுத்திகரிப்பதற்கான தொழில்துறை செயல்பாடுகள் நடைபெற்றன.
உலோக ஆண்டிமனியின் மிகப்பெரிய பயன்பாடுகளில் ஒன்றாக முன்னணி வகிப்பது இதனுடைய கலப்புலோகப் பண்பாகும். ஈயம் மற்றும் வெள்ளீயத்துடன் ஆண்டிமனியை கலந்து தயாரிக்கப்படும் கலப்புலோகம் அதிகமான பயன்களைக் கொடுக்கிறது. ஈயம்-ஆண்டிமனி கலப்புலோகத்தைக் கொண்டு தயாரிக்கப்படும் தகடுகள் ஈய – அமில மின்கலன்களில் பயன்படுத்தப்படுகிறது. மேலும், இணைப்புலோகம், தோட்டாக்கள், சாதாரண தாங்கு உருளைகள் ஆகியவற்றை மேம்படுத்தவும் ஆண்டிமனி, ஈயம், வெள்ளீயம் தனிமங்களின் கலப்புலோகம் பயன்படுகிறது. ஆண்டிமனி சேர்மங்கள் பல வணிக மற்றும் உள்நாட்டு உற்பத்திப் பொருட்களில் காணப்படும் குளோரின் மற்றும் புரோமின் வாயுக்களாலான தீயணைப்பு ஒடுக்கிகளில் முக்கிய கூட்டுப்பொருள்களாகப் பயன்படுகின்றன. மைக்ரோ மின்னியல் துறையில் ஆண்டிமனியைப் பயன்படுத்துவது வளர்ந்துவரும் ஒரு துறையாக மாறிவருகிறது.
பண்புகள்
[தொகு]


நிக்டோசன் என்றழைக்கப்படும் நெடுங்குழு தனிமங்கள் 15 இல் ஒன்றாகும். இதன் எலக்ட்ரான் ஏற்புத்திறன் 2.05 ஆகும். தனிம வரிசை அட்டவனை போக்குகளுக்கு இணங்க வெள்ளீயம் அல்லது பிசுமத்தை விட எலக்ட்ரான் ஏற்புத்தன்மை அதிகமாகவும் தெலூரியம் அல்லது ஆர்சனிக்கை விட குறைவான எலக்ட்ரான் ஏற்புத் திறனையும் ஆண்டிமனி பெற்றுள்ளது. அறை வெப்பநிலையில் ஆண்டிமனி நிலைப்பித் தன்மையுடனும், காற்ருடன் சேர்த்து சூடுபடுத்தும் போது வினைபுரிந்து ஆண்டிமனி டிரையாக்சைடையும் தருகிறது (Sb2O3).
ஆண்டிமனி வெள்ளி போன்ற பளபளப்பான ஒரு உலோகப்போலியாகும். மோவின் அளவுகோலில் இதனுடைய கடினத்தன்மை மதிப்பு 3 ஆகும். அதாவது கடினமான பொருட்களை உருவாக்க உதவும் மிகவும் மென்மையான பொருளாக ஆண்டிமனி கருதப்படுகிறது. ஆண்டிமனியாலான நாணயங்கள் 1931 ஆம் ஆண்டில் சீனாவின் குயிசோவ் மாகாணத்தில் வெளியிடப்பட்டன, ஆனால் ஆயுள் குறைவாக இருந்ததால் உற்பத்தியானது விரைவில் நிறுத்தப்பட்டது [2]. அமிலங்களால் அரிக்கப்படுவதை தடுக்கும் எதிர்ப்பியாகவும் ஆண்டிமனி பயன்படுத்தப்படுகிறது.
ஆண்டிமனிக்கு நான்கு புற வேற்றுமை வடிவங்கள் உள்ளன. அவற்றில் ஒன்று நிலைப்புத் தன்மை கொண்டது ஆகும். ஏனைய மூன்றும் (வெடிக்கும் ஆண்டிமனி, கருப்பு ஆண்டிமனி, மஞ்சள் ஆண்டிமனி) சிற்றுறுதி நிலையில் உள்ளன. தனிமநிலை ஆண்டிமனி வெள்ளியைப் போன்று வெண்மையாக நொறுங்கக்கூடிய உலோகப்போலியாகும். உருகிய ஆண்டிமனியை மெல்ல குளிர்விக்கும் போது அது முக்கோண அலகுகளாக படிகமாகின்றது. ஆர்சனிக்கின் புறவேற்றுமை வடிவமான சாம்பல் நிற ஆர்சனிக்கை ஒத்த வடிவில் உள்ளது. ஆண்டிமனி முக்குளோரைடை மின்னாற்பகுத்து அரியவகை புறவேற்றுமை வடிவமான வெடிக்கும் ஆண்டிமனி தயாரிக்கப்படுகிறது. ஒரு கூர்மையான வெப்ப உமிழ் வினை செயல்பாட்டின் வழியாக இது உருவாகிறது. தனிமநிலை ஆண்டிமனி உருவாகும் போது வெண்புகை தோன்றுகிறது. குழவியிலிட்டு ஓர் உலக்கையால் இதை இடித்தால் கடும் வெடிப்போசை உண்டாகிறது. ஆண்டிமனி ஆவியை திடீரெனக் குளிர்வித்தால் கருப்பு ஆண்டிமனி உருவாகிறது. சிகப்பு பாசுபரசு மற்றும் கருப்பு ஆர்சனிக் தனிமங்கள் பெற்றுள்ளதைப் போன்ற அதே படிகவடிவத்தையே கருப்பு ஆண்டிமனியும் பெற்றுள்ளது.
100 °செல்சியசு வெப்பநிலையில் இது மெதுவாக நிலைப்புத்தன்மை கொண்ட ஆண்டிமனியாக மாறுகிறது. மஞ்சள் ஆண்டிமனிதான் நிலைப்புத்தன்மை குறைந்த புறவேற்றுமை வடிவ ஆண்டிமனியாகும். சிடைபினை - 90° செல்சியசு வெப்பநிலையில் ஆக்சிசனேற்றம் செய்தால் இதைத் தயாரிக்க இயலும். இதற்கு அதிமான வெப்பநிலையில் இச்சிற்றுறுதி நிலை ஆண்டிமனி அதிக நிலைப்புத்தன்மை கொண்ட கருப்பு ஆண்டிமனியாக மாறுகிறது [3]. தனிமநிலை ஆண்டிமனி ஓரடுக்கு படிக அமைப்பை (இடக்குழு ஆர்3எம் எண் 166) ஏற்றுக்கொள்கிறது, இவ்வமைப்பில் அடுக்குகள் இணைக்கப்பட்டும் சுருங்கியும் உள்ள ஆறு உறுப்பு வளையங்கள் உள்ளன. இவற்றுக்கு அடுத்தும் அடுத்தடுத்தும் உள்ள இரட்டை அடுக்குகள் ஒவ்வொன்றிலும் மூன்று அணுக்கள் அடுத்துள்ள மூன்று அணுக்களை விட நெருக்கமாக அமைந்து ஒழுங்கற்ற எண்முக வடிவ அணைவாக உருவாகின்றன. ஒப்பீட்டளவில் நெருங்கிய இப்பொதிவு 6697 கிராம் / செ.மீ 3 என்ற அதிக அடர்த்தியைக் கொடுக்கிறது. ஆனால் அடுக்குகளுக்கு இடையிலான பலவீனமான பிணைப்பு ஆண்டிமனிக்கு குறைந்த கடினத்தன்மையையும் நொருங்கும் தன்மையையும் கொடுக்கிறது.
பயன்பாடுகள்
[தொகு]மலிவு விலையில் கிடைக்கும் இடங்கள்
[தொகு]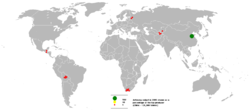
2005ல், சீனாதான் அதிகம் அந்திமனியைத் தோண்டி எடுத்த நாடு. அந்நாட்டின் உற்பத்தி உலகில் கிடைக்கும் மொத்த அந்திமனியில் 84%. சீனாவை அடுத்து மிக பின்நிலையில் இரண்டாவதாக தென் ஆப்பிரிக்காவும், அதன் பின் பொலிவியா, தஜிக்ஸ்தான் உள்ளன.
| நாடு | டன் | மொத்ததில் எவ்வளவு % |
|---|---|---|
| சீனா | 126,000 | 84.0 |
| தென் ஆப்பிரிக்கா | 6,000 | 4.0 |
| பொலிவியா | 5,225 | 3.5 |
| தஜிக்ஸ்தான் | 4,073 | 2.7 |
| உருசியா | 3,000 | 2.0 |
| முதல் 5 மட்டும் | 144,298 | 96.2 |
| உலகில் மொத்தம் | 150,000 | 100.0 |
Chiffres de 2003, métal contenue dans les minerais et concentrés, source: L'état du monde 2005
சேர்மங்கள்
[தொகு]ஆண்டிமனி சேர்மங்கள் பெரும்பாலும் அவற்றின் ஆக்சிசனேற்ற நிலைக்கு ஏற்ப வகைப்படுத்தப்படுகின்றன: பொதுவாக Sb(III) மற்றும் Sb(V) என்ற இரண்டு ஆக்சிசனேற்ற நிலைகளில் ஆண்ட்டிமனி காணப்படுகிறது. +5 ஆக்சிஜனேற்ற நிலை மிகவும் நிலைப்புத்தன்மையுடன் உள்ளது.
வாயு நிலையில் சேர்மத்தின் மூலக்கூறு Sb4O6 ஆகும் ஆனால் அது ஒடுக்கமடையும்போது பலபடியாதலுக்கு உட்படுகிறது. ஆண்டிமனியை செறிவூட்டப்பட்ட நைட்ரிக் அமிலத்துடன் சேர்த்து ஆக்சிசனேற்றம் செய்தால் மட்டுமே ஆண்டிமனி பென்டாக்சைடு உருவாக்க முடியும். ஆண்ட்டிமனி கலப்பு இணைதிறன் கொண்ட ஆண்டிமனி டெட்ராக்சைடு போன்ற ஆக்சைடையும் உருவாக்குகிறது. இது Sb (III) மற்றும் Sb (V) என்ற இரண்டு ஆக்சிசனேற்ற நிலைகளையும் கொண்டுள்ளது. பாசுபரசு மற்றும் ஆர்சனிக் ஆக்சைடுகள் போலல்லாமல் இந்த ஆக்சைடுகள் ஈரியல்பு , ஆக்சைடுகளாகும் நன்கு வரையறுக்கப்பட்ட ஆக்சோ அமிலங்களாக இவை உருவாவதில்லை. அமிலங்களுடன் வினைபுரிந்து இவை ஆண்டிமனி உப்புகளை உருவாக்குகின்றன. Sb(OH)3 என்ற வாய்ப்பாடுடைய ஆண்டிமோனசு அமிலம் அறியப்படவில்லை. ஆனால் இதன் இணைகாரமான ஆண்டிமோனைட்டு ([Na3SbO3]4) சோடியம் ஆக்சைடையும் Sb4O6 சேர்மத்தையும் சேர்த்து உருக்கினால் ஆண்டிமோனைட்டு உருவாகிறது. இடைநிலைத் தனிமங்களின் ஆண்டிமோனைட்டுகளும் அறியப்படுகின்றன. ஆண்டிமோனிக் அமிலம் நீரேற்றாக மட்டுமே HSb(OH)6 அறியப்படுகின்றன. ஆண்டிமோனேட்டு எதிர்மின் அயனியாக Sb(OH)−6 இவை உப்புகளை உருவாக்குகின்றன. இந்த அயனியைக் கொண்ட ஒரு கரைசல் நீர்நீக்கம் செய்யப்படும்போது உருவாகும் வீழ்படிவில் கலப்பு ஆக்சைடுகள் காணப்படுகின்றன. சிடிப்னைட்டு (Sb2S3) பைரார்கைரைட்டு (Ag3SbS3),சிங்கெனைட்டு, யேம்சோனைட்டு, பவுலாங்கெரைட்டு உள்ளிட்டவையும் சல்பைடுகளாகும். பல ஆண்டிமனி தாதுக்கள் சல்பைடுகளாகும். ஆண்டிமனி பெண்டாசல்பைடு ஒரு விகிதச்சமமற்ற சல்பைடு ஆகும். இதில் +3 என்ற ஆக்சிசனேற்ற நிலையிலும் S-S பிணைப்புகளோடும் ஆண்டிமனி உள்ளது. [Sb6S10]2− மற்றும் [Sb8S13]2− உள்ளிட்ட பல தயோ ஆண்டிமோனைடுகளும் அறியப்படுகின்றன.
ஆலைடுகள்
[தொகு]ஆண்டிமனி SbX3 மற்றும் SbX5 என்ற இரண்டு வகையான வரிசைகளில் ஆலைடுகளை உருவாக்குகிறது. SbF3, SbCl3, SbBr3, மற்றும் SbI3 ஆகிய டிரை ஆலைடுகள் அனைத்தும் முக்கோண பட்டைக்கூம்பு வடிவத்தை ஏற்றுள்ள மூலக்கூற்று சேர்மங்களாக உள்ளன. Sb2O3 உடன் ஐதரசன் புளோரைடை சேர்த்து வினைபுரியச் செய்தால் ஆண்டிமனி டிரைபுளோரைடு (SbF3) உருவாகிறது.
- Sb
2O
3 + 6 HF → 2 SbF
3 + 3 H
2O
இது இலூயிக் அமிலப் பண்பைக் கொண்டதாகும். புளோரைடு அயனிகளை ஏற்றுக்கொண்டு அணைவு எதிர்மின் அயனிகளாக SbF−
4 மற்றும் SbF2−
5 உருவாகிறது. உருகிய நிலையில் உள்ள ஆண்டிமனி டிரைபுளோரைடு ஒரு மந்தமான மின் கடத்தியாகும். Sb2S3 உடன் ஐதரோகுளோரிக் அமிலத்தை சேர்த்து வினைபுரியச் செய்தால் ஆண்டிமனி டிரைகுளோரைடு உருவாகிறது.
- Sb
2S
3 + 6 HCl → 2 SbCl
3 + 3 H
2S

ஆண்டிமனி பெண்டாபுளோரைடு (SbF
5), ஆண்டிமனி பெண்டாகுளோரைடு (SbCl
5) உள்ளிட்ட பெண்டா ஆலைடுகள் வாயுநிலையில் முக்கோண இரட்டைக்கூர்நுனி கோபுர வடிவில் உள்ளன. ஆனால் நீர்ம நிலையில் ஆண்டிமனி பெண்டாபுளோரைடு பல்பகுதிய நிலையிலும், ஆண்டிமனி பெண்டாகுளோரைடு ஒருபகுதிய நிலையிலும் உள்ளன[4]:761
ஆண்டிமனி பெண்டாபுளோரைடு ஒரு வலிமை மிக்க இலூயிக் அமிலமாகும். புளோரோ ஆண்டிமோனிக் அமிலம் ("H2SbF7") என்ற மிகை அமிலத்தை தயாரிக்க இது பயன்படுகிறது. பாசுபரசு மற்றும் ஆர்சனிக் தனிமங்களைக்காட்டிலும் ஆண்டிமனிக்கு ஆக்சோ ஆலைடுகள் மிகப்பொதுவாகக் காணப்படுகின்றன. ஆண்டிமனி டிரையாக்சைடு அடர் அமிலத்தில் கரைந்து ஆண்டிமனி ஆக்சிகுளோரைடு போன்ற ஆக்சோ ஆண்டிமோனைல் சேர்மங்களை உருவாக்குகிறது[4]:764
நச்சுத்தன்மை
[தொகு]ஆண்டிமனியின் சில சேர்மங்கள் நச்சுத்தன்மையுடன் காணப்படுகின்றன. குறிப்பாக ஆண்டிமனி டிரையாக்சைடு மற்றும் ஆண்டிமனி பொட்டாசியம் டார்ட்ரேட்டு போன்றவை நச்சகளாகும். ஆர்சனிக் நச்சின் விளைவுகள் இவற்றுக்கும் பொருந்தும். ஆண்டிமனி சார்ந்த தொழில் செய்பவர்கள் மீதான வெளிப்பாடு சுவாச எரிச்சல், தோலில் ஆண்டிமனி புள்ளிகள், இரைப்பை குடல் அறிகுறிகள் மற்றும் இதய நோய் பாதிப்புகள் ஏற்படும். கூடுதலாக, ஆன்டிமனி டிரையாக்சைடு மனிதர்களுக்கு புற்றுநோயை உருவாக்கலாம். ஆண்டிமனி மற்றும் ஆண்டிமனி சேர்மங்களை உள்ளிழுத்தல், வாய்வழி அல்லது தோல் மூலம் தொடர்ந்து உட்சென்றால் மனிதர்களிடமும் விலங்குகளிலும் பாதகமான சுகாதார விளைவுகள் காணப்படுகின்றன.
மேற்கோள்கள்
[தொகு]- ↑ David Kimhi's Commentary on Jeremiah 4:30 and I Chronicles 29:2; Hebrew: פוך/כְּחֻל, Aramaic: כּוּחְלִי/צדידא; Arabic: كحل, and which can also refer to antimony trisulfide. See also Z. Dori, Antimony and Henna (Heb. הפוך והכופר), Jerusalem 1983 (Hebrew).
- ↑ "Metals Used in Coins and Medals". ukcoinpics.co.uk. Archived from the original on 2010-12-26. பார்க்கப்பட்ட நாள் 2018-03-23.
- ↑ Norman, Nicholas C (1998). Chemistry of arsenic, antimony, and bismuth. pp. 50–51. பன்னாட்டுத் தரப்புத்தக எண் 978-0-7514-0389-3.
- ↑ 4.0 4.1 Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. பன்னாட்டுத் தரப்புத்தக எண் 978-0-12-352651-9.
{{cite book}}: Unknown parameter|last-author-amp=ignored (help)
உசாத் துணை
[தொகு]- W. F. Albright "Notes on Egypto-Semitic Etymology. II", The American Journal of Semitic Languages and Literatures, Vol. 34, No. 4. (Jul., 1918), pp. 215–255. JSTOR link. esp p. 230
- Endlich, F.M. "On Some Interesting Derivations of Mineral Names", The American Naturalist, Vol. 22, No. 253. (Jan., 1888), pp. 21–32. JSTOR link. p. 28
- Kirk-Othmer Encyclopedia of Chemical Technology, 5th ed. 2004. Entry for antimony.
- Lippmann, E O von [Edmund Oscar]. 1919. Entstehung und Ausbreitung der Alchemie, teil 1. Berlin: Julius Springer. In German.
- Moorey, PRS. 1994. Ancient Mesopotamian Materials and Industries: the Archaeological Evidence. New York: Clarendon Press.
- Priesner, Claus and Figala, Karin, eds. 1998. Alchemie. Lexikon einer hermetischen Wissenschaft. München: C.H. Beck. 412 p. In German.
- Sarton, George. 1935. Review of Al-morchid fi'l-kohhl, ou Le guide d'oculistique, translated by Max Meyerhof. Isis (Feb. 1935), 22(2):539-542 (The journal Isis is in the JSTOR archive.) In French.
- Shotyk, William; Krachler, Michael; Chen, Bin. Contamination of Canadian and European bottled waters with antimony from PET containers J. Environ. Monit 2006, 8:288-292 DOI: 10.1039/b517844b
- Los Alamos National Laboratory – Antimony
- Public Health Statement for Antimony
- Wakayama, Hiroshi, "Revision of Drinking Water Standards in Japan", Ministry of Health, Labor and Welfare (Japan), 2003

