காட்மியம்

| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பொது | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| பெயர், குறி எழுத்து, தனிம எண் | காட்மியம், Cd, 48 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வேதியியல் பொருள் வரிசை | பிறழ்வரிசை மாழைகள் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, வலயம் | 12, 5, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| தோற்றம் | siவெள்ளி போல் சாம்பல் மாழை  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு நிறை (அணுத்திணிவு) | 112.411(8) g/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| எதிர்மின்னி அமைப்பு | [Kr] 4d10 5s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| சுற்றுப் பாதையிலுள்ள எதிர்மின்னிகள் (எலக்ட்ரான்கள்) | 2, 8, 18, 18, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| இயல்பியல் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| இயல் நிலை | திண்மை | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அறை வெ.நி அருகில்) | 8.65 கி/செ.மி³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகுநிலையில் நீர்மத்தின் அடர்த்தி | 7.996 g/cm³ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| உருகு வெப்பநிலை | 594.22 K (321.07 °C, 609.93 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| கொதி நிலை | 1040 K (767 °C, 1413 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| நிலை மாறும் மறை வெப்பம் | 6.21 கி.ஜூ/மோல் (kJ/mol) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வளிமமாகும் வெப்ப ஆற்றல் | 99.87 கி.ஜூ/மோல் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | (25 °C) 26.020 ஜூ/(மோல்·K) J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | அறுகோண பட்டகம் | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஆக்சைடு நிலைகள் | 2 (மென கார ஆக்ஸைடு) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| எதிர்மின்னியீர்ப்பு | 1.69 (பௌலிங் அளவீடு) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் | 1st: 867.8 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2nd: 1631.4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3rd: 3616 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணு ஆரம் | 155 பிமீ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அணுவின் ஆரம் (கணித்) | 161 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| கூட்டிணைப்பு ஆரம் | 148 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வான் டெர் வால் ஆரம் | 158 பி.மீ (pm) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வேறு பல பண்புகள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| காந்த வகை | தரவு இல்லை | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மின்தடைமை | (22 °C) 72.7 nΩ·m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்பக் கடத்துமை | (300 K) 96.6 வாட்/(மீ·கெ) W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| வெப்ப நீட்சி | (25 °C) 30.8 மைக்.மீ/(மி.மீ·கெ) µm/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ஒலியின் விரைவு (மெல்லிய கம்பி வடிவில்) | (20 °C) 2310 மீ/நொடி | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| யங்கின் மட்டு | 50 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Shear modulus | 19 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| அமுங்குமை | 42 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பாய்சான் விகிதம் | 0.30 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மோவின்(Moh's) உறுதி எண் | 2.0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| பிரிநெல் உறுதிஎண் Brinell hardness]] | 203 MPa (மெகாபாஸ்) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS பதிவெண் | 7440-43-9 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| குறிபிடத்தக்க ஓரிடத்தான்கள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| மேற்கோள்கள் | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
காட்மியம் (Cadmium) என்பது Cd என்ற மூலக்கூற்று வாய்ப்பாடு கொண்ட ஒரு தனிமமாகும். இதனுடைய அணு எண் 48 ஆகும். நீலம் கலந்த வெண்மை நிறமுடைய மென்மையான இவ்வுலோகம் 12 ஆவது தொகுதியில் காணப்படும் நிலைப்புத்தன்மை கொண்ட மற்ற இரண்டு தனிமங்களான துத்தநாகம், பாதரசம் போன்ற தனிமங்களின் வேதியியல் பண்புகளை ஒத்த பண்புகளைக் கொண்டுள்ளது.
துத்தநாகம் போlல காட்மியமும் இதன் சேர்மங்கள் பெரும்பாலானவற்றில் ஆக்சிசனேற்ற நிலை +2 இல் உள்ளது. மற்றும் பாதரசம் போல 3 முதல் 11 வரையான குழுக்களில் உள்ள இடைநிலைத் தனிமங்களைக் காட்டிலும் இது குறைவான உருகுநிலையைக் கொண்டுள்ளது. காட்மியம் மற்றும் குழு 12 இல் உள்ள அதன் பிற இணைத்தனிமங்களும் பெரும்பாலும் இடைநிலைத் தனிமங்களாகக் கருதப்படுவதில்லை. ஏனெனில் அவை d அல்லது f எலக்ட்ரான் கூட்டில் பகுதியாக நிரம்பிய எலக்ட்ரான்களைப் பெற்றிருப்பதில்லை. பூமியின் மேற்புறத்தில் காட்மியத்தின் சராசரி செறிவு மில்லியனுக்கு 0.1 மற்றும் 0.5 பகுதிகள் ஆக உள்ளது. 1817 ஆம் ஆண்டு செருமனியில் சிட்ரோமேயர் மற்றும் எர்மான் ஆகியோரால் துத்தநாக கார்பனேட்டில் உள்ள ஒரு மாசாகக் கண்டறியப்பட்டது. பெரும்பாலான துத்தநாக தாதுகளில் காட்மியம் ஒரு சிறிய பகுதியாகத் தோன்றுகிறது. துத்தநாக உற்பத்தியின் போது ஓர் உடன் விளைபொருளாக காட்மியமும் உருவாகிறது. எஃகின் மீது முலாம் பூசுகையில் அசிப்புத் தடுப்பியாக காட்மியம் நீண்ட காலத்திற்குப் பயன்படுத்தப்பட்டு வந்தது. வண்ண கண்ணாடி, மற்றும் நெகிழி உறுதிப்படுத்துதலில் காட்மியம் சேர்மங்கள் சிவப்பு, ஆரஞ்சு மற்றும் மஞ்சள் நிறமிகளாகப் பயன்படுத்தப்படுகின்றன, நச்சுத்தன்மையின் காரணமாக காட்மியத்தின் பயன்பாடு பொதுவாக குறைந்து வருகிறது. அபாயகரமான பொருட்களுக்கான ஐரோப்பிய கட்டுப்பாட்டு அமைப்பு காட்மியத்தை அபாயகரமான பொருட்களின் பட்டியலில் சேர்த்துள்ளது. நிக்கல்-காட்மியம் மின்கலன்கள் தற்காலத்தில் நிக்கல்-உலோக ஐதரைடு மற்றும் இலித்தியம் -இரும்பு மின்கலன்களால் இடப்பெயர்ச்சி செய்யப்பட்டுள்ளன. காட்மியம் தெலூரைடு சூரிய மின் பலகைகளில் பயன்படுவது தற்போதைய புதிய பயன்பாடாகும்.
உயிரினங்களில் காட்மியத்தின் பயன்பாடு ஏதும் அறியப்படவில்லை என்றாலும், காடிமியம் சார்ந்த கார்போனிக் அன் ஐதரேசு நொதியாக கடல்வாழ் இருகலப்பாசிகளில் காணப்படுகிறது.
வரலாறு
[தொகு]
1817 ஆம் ஆண்டில் காட்மியம் ஒரே நேரத்தில் பிரெட்ரிக் சிட்ரோமேயர்[1] மற்றும் கார்ல் சாமுவேல் லெபெரெக்ட் எர்மன் ஆகிய இருவரும் செருமனியில் துத்தநாக கார்பனேட்டில் ஒரு மாசுப்பொருளாக கண்டுபிடித்தார்கள். இலத்தீன் மொழியில் காட்மியத்தை காட்மியா என்றும் கிரேக்க மொழியில் காலமைன் என்றும் அழைத்தார்கள். காட்மியத்தைக் கொண்டிருக்கும் கனிமங்களின் கலவையை திபெசு நகரத்தை தோற்றுவித்த தொன்மவியல் கதாபாத்திரத்தின் பெயரான காட்மசின் பெயர் இதற்கு சூட்டப்பட்டது. சிட்ரோமேயர் இந்தப் புதிய தனிமத்தை துத்தநாக கார்பனேட்டில் (காலமைன்) உள்ள ஒரு மாசுப்பொருளாகக் கண்டறிந்தார், மேலும், 100 ஆண்டுகளாக இந்த உலோகத்தை உற்பத்தி செய்யும் ஒரே முக்கியமான நாடாக செருமனி இருந்தது. இந்த தனிமம் துத்தநாக தாதுவில் காணப்பட்டதால், காலமைன் என்ற இலத்தீன் வார்த்தையின் பெயரைத் தொடர்ந்து காட்மியம் எனப்பெயரிடப்பட்டது. சில தூய்மையற்ற காலமைன் மாதிரிகள் சூடாக்கும்போது நிறம் மாறின. ஆனால் தூய காலமைன் அவ்வாறு நிறம் மாறவில்லை என்பதை சிட்ரோமேயர் கவனித்தார். இந்த முடிவுகளை ஆராய்வதில் அவர் விடாமுயற்சியுடன் இருந்தார். இறுதியில் சல்பைடை வறுத்தும் ஒடுக்கியும் காட்மியம் உலோகத்தை தனிமைப்படுத்தினார். காட்மியம் மஞ்சள் ஒரு நிறமியாக 1840 ஆம் ஆண்டுகளில் அங்கீகரிக்கப்பட்டது, ஆனால் காட்மியம் பற்றாக்குறை இந்த பயன்பாட்டை மட்டுப்படுத்தியது[2][3][4]
காட்மியம் மற்றும் அதன் சேர்மங்களின் சில வகைகள் மற்றும் அவற்றின் செறிவுகளில் நச்சுத்தன்மையுள்ளவை என்றாலும் காட்மியம் அயோடைடு விரிந்த மூட்டு நோய்க்கான சிகிச்சையில் ஒரு மருந்தாகப் பயன்படுத்தப்பட்டது[5] என்று 1907 ஆம் ஆண்டில் வந்த பிரித்தானிய மருந்துகள் தொகுப்பு நூல் கூறுகிறது.
1907 ஆம் ஆண்டில் சர்வதேச வானியல் ஒன்றியம் பன்னாட்டு ஆங்சுட்ராமை ஒரு சிவப்பு காட்மியம் நிறமாலை கோடு அடிப்படையில் வரையறுத்தது[6][7]. 1927 ஆம் ஆண்டில் நடைபெற்ற எடைகள் மற்றும் அளவீடுகள் பற்றிய 7 வது பொது மாநாட்டில் இந்த வரையறை ஏற்றுக்கொள்ளப்பட்டது. 1960 ஆம் ஆண்டில் மீட்டர் மற்றும் ஆங்சுட்ராம் இரண்டின் வரையறைகளும் கிரிப்டனைப் பயன்படுத்தும் வகையில் மாற்றப்பட்டன[8]
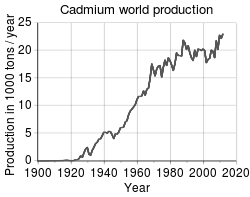
1930 மற்றும் 1940 ஆம் ஆண்டுகளில் காட்மியத்தின் தொழில்துறை அளவிலான உற்பத்தி தொடங்கிய பின்னர் இரும்பு மற்றும் எஃகு ஆகியவற்றின் அரிமானத்தை தடுக்க மேற்பூச்சாகப் பயன்படுத்தத் தொடங்கியது காட்மியத்தின் முக்கிய பயன்பாடாக மாறியது. 1944 ஆம் ஆண்டில் 62 சதவீதமும் 1956 ஆம் ஆண்டில் 59% சதவீத காட்மியமும் அமெரிக்காவில் முலாம் பூசுவதற்குப் பயன்படுத்தப்பட்டது[9].1956 ஆம் ஆண்டு அமெரிக்காவில் சல்பைடுகள் மற்றும் காட்மியத்தின் செலினைடுகளிலிருந்து பெறப்பட்ட காட்மியத்தின் 24 சதவீதம் சிவப்பு, ஆரஞ்சு மற்றும் மஞ்சள் நிறமிகளாக இரண்டாவது பயன்பாட்டிற்கு பயன்படுத்தப்பட்டது[9]
காட்மியம் லாரேட் மற்றும் காட்மியம் சிடீயரேட் போன்ற கார்பாக்சிலேட்டு காட்மியம் வேதிப்பொருட்கள் பாலி வினைல் குளோரைடு மீது பூசப்பட்ட போது அவற்றின் நிலைப்படுத்தும் பண்பு அதிகரித்ததால் 1970 ஆம் ஆண்டுகள் மற்றும் 1980 ஆம் ஆண்டுகளில் இந்த சேர்மங்களின் பயன்பாடு அதிகரித்தது. நிறமிகள் பூச்சுகள், நிலைப்படுத்திகள், மற்றும் உலோகக்கலவைகள் போன்ற பயன்பாடுகளுக்கான காட்மியத்தின் தேவை 1980 மற்றும் 1990 ஆம் ஆண்டுகளில் சுற்றுச்சூழல் மற்றும் உடல் நலக் கட்டுப்பாடுகள் தொடர்பாக வெகுவாக குறைந்தது. 2006 ஆம் ஆண்டில் தயாரிக்கப்பட்ட மொத்த காட்மியத்தில் 7 சதவீதம் மட்டுமே முலாம் பூசுவதற்குப் பயன்படுத்தப்பட்டது, மேலும் 10 சதவீதம் மட்டுமே நிறமிகளுக்குப் பயன்படுத்தப்பட்டது. அதே நேரத்தில் இந்த நுகர்வு குறைவு நிக்கல்-காட்மியம் மின்கலன்களுக்கான காட்மியம் தேவையை அதிகரித்து ஈடுசெய்யப்பட்டது. 2006 ஆம் ஆண்டில் அமெரிக்காவில் பயன்படுத்தப்பட்ட காட்மியத்தில் 81 சதவீதம் நிக்கல்-காட்மியம் மின்கலன்களுக்கு மட்டுமே பயன்படுத்தப்பட்டது[10].
பண்புகள்
[தொகு]இயற்பியல் பண்புகள்
[தொகு]காட்மியம் என்பது ஒரு மென்மையான தகடாகவும் கம்பியாகவும் மாற்றிக் கொள்ளக்கூடிய நீல நிறம் கொண்ட இரட்டை இணைதிற உலோகமாகும். காட்மியம் பல விதங்களில் துத்தநாகத்தை ஒத்திருக்கிறது, ஆனால் அணைவுச் சேர்மங்களை இது உருவாக்குகிறது [11]. மற்ற உலோகங்களைப் போலல்லாமல் காட்மியம் அரிப்பை எதிர்க்கும் உலோகமாக பயன்படுகிறது. பிற உலோகங்கள் மீது ஒரு பாதுகாப்புத் தகடாகப் பயன்படுத்தப்படுகிறது. மொத்த உலோகமாக, காட்மியம் தண்ணீரில் கரைவதில்லை. எளிதில் தீப்பற்றி எரியக்கூடியதும் அல்ல. இருப்பினும், இதன் தூள் வடிவம் எரிந்து நச்சு வாயுக்களை வெளி விடுகிறது [12]
வேதியியல் பண்புகள்
[தொகு]காட்மியம் பொதுவாக +2 என்ற ஆக்சிசனேற்ற நிலையை வெளிப்படுத்தினாலும் +1 என்ற ஆக்சிசனேற்ற நிலையையும் வெளிப்படுத்துகிறது. காட்மியமும் குழு 12 இல் உள்ள அதன் பிற இணைத்தனிமங்களும் தனிமநிலை அல்லது பொதுவான ஆக்சிசனேற்ற நிலையில் d அல்லது f எலக்ட்ரான் கூட்டில் பகுதியாக நிரம்பிய எலக்ட்ரான்களைப் பெற்றிருக்காததால் பெரும்பாலும் இடைநிலைத் தனிமங்களாகக் கருதப்படுவதில்லை[13].
காட்மியம் காற்றில் எரிந்து படிக உருவமற்ற பழுப்பு நிறமான காட்மியம் ஆக்சைடு (CdO) உருவாகிறது. இச்சேர்மத்தின் படிக வடிவம் அடர் சிவப்பு நிறத்தில் காணப்படுகிறது. சூடுபடுத்தும் போது இதன் நிறம் துத்தநாக ஆக்சைடைப் போல நிற மாற்றமடைகிறது. காட்மியம், ஐதரோகுளோரிக் அமிலத்தில் கரைந்து காட்மியம் குளோரைடு (CdCl2) ஆகவும், கந்தக அமிலத்தில் கரைந்து காட்மியம் சல்பேட்டு (CdSO4) ஆகவும், நைட்ரிக் அமிலத்தில் கரைந்து காட்மியம் நைட்ரேட்டு (Cd(NO3)2) ஆகவும் உருவாகிறது. காட்மியத்தை காட்மியம் குளோரைடு மற்றும் அலுமினியம் குளோரைடு கலந்த கலவையில் கரைத்தால் Cd22+ நேர்மின் அயனி உருவாகிறது. இதில் காட்மியம் +1 ஆக்சிசனேற்ற நிலையில் காணப்படுகிறது.இது Hg22+ நேர்மின் அயனி பாதரச(I) குளோரைடில் இருப்பதைப் போன்றது ஆகும்[11]
- Cd + CdCl2 + 2 AlCl3 → Cd2(AlCl4)2.
நியூக்ளியோ காரங்கள், அமினோ அமிலங்கள், வைட்டமின்கள் ஆகியவற்றுடன் கூடிய பல காட்மிய அணைவுச் சேர்மங்களின் இருப்பு உறுதிப்படுத்தப்பட்டுள்ளன[14].
ஐசோடோப்புகள்
[தொகு]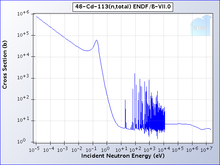
இயற்கையாகத் தோன்றும் காட்மியம் 8 ஐசோடோப்புகளைக் கொண்டுள்ளது. அவற்றில் இரண்டு கதிரியக்க ஐசோடோப்புகளாகும். மூன்று ஐசோடோப்புகள் சிதைவு அடையும் என்று எதிர்பார்க்கப்பட்டாலும் அவற்றை ஆய்வகச் சூழ்நிலையில் அவ்வாறு நிகழவில்லை. 113Cd மற்றும் 116Cd எனப்படும் இரண்டும் இயற்கை கதிரியக்க ஐசோடோப்புகளாகும். 113Cd ஐசோடோப்பு பீட்டா சிதைவு அடைந்து 7.7 × 1015 ஆண்டுகளை அரைவாழ்வுக் காலமாகப் பெற்றுள்ளது. 116Cd ஐசோடோப்பு இரண்டு நியூட்ரினோ இரட்டைப் பீட்டா சிதைவை அடைந்து 2.9 × 1019 ஆண்டுகளை அரைவாழ்வுக் காலமாகப் பெற்றுள்ளது. இரட்டை எலக்ட்ரான் பிடிப்பு தன்மை கொண்ட 106Cd, 108Cd ஐசோடோப்புகள் இரண்டும் இரட்டை பீட்டா சிதைவு கொண்ட 114Cd ஐசோடோப்பும் இதர காட்மியம் ஐசோடோப்புகளாகும். இம்மூன்றின் அரைவாழ்வுக் காலம் மிகக்குறைந்த அளவுகளாக உறுதி செய்யப்பட்டுள்ளது. குறைந்தபட்சம் – 110Cd, 111Cd, மற்றும் 112Cd – ஐசோடோப்புகள் நிலைப்புத் தன்மை கொண்டிருக்கலாம் என கருதப்படுகிறது. இயற்கையாகத் தோன்றாத காட்மியத்தின் இதர ஐசோடோப்புகளில் 462.6 நாட்களை அரைவாழ்வுக் காலமாகக் கொண்ட 109Cd ஐசோடோப்பும் 53.46 மணிநேரத்தை அரைவாழ்வுக் காலமாகக் கொண்ட 115Cd ஐசோடோப்பும் மிக அதிக நிலைப்புத்தன்மை கொண்ட ஐசோடோப்புகளாகக் கருதப்படுகின்றன. காட்மியத்தின் இதர கதிரியக்க ஐசோடோப்புகள் யாவும் 2.5 மணி நேரத்திற்கும் குறைவான அரைவாழ்வுக் காலத்தைப் பெற்றவையாக உள்ளன. இவற்றிலும் பல ஐசோடோப்புகள் 5 நிமிடத்திற்கும் குறைவான அரைவாழ்வுக் காலத்தைப் பெற்றவையாக உள்ளன. காட்மியத்தின் சிற்றுறுதி ஐசோடோப்புகளாக 8 ஐசோடோப்புகள் அறியப்படுகின்றன. 113mCd (t1⁄2 = 14.1 ஆண்டுகள்), 115mCd (t1⁄2 = 44.6 நாட்கள்), மற்றும் 117mCd (t1⁄2 = 3.36 மணிகள்) போன்ற சிற்றுறுதி ஐசோடோப்புகள் அதிக நிலைப்புத் தன்மை கொண்டவையாகக் கருதப்படுகின்றன[15]
அணு நிறை 94.950 u (95Cd) to 131.946 u (132Cd) கொண்ட காட்மியத்தின் ஐசோடோப்புகள் அறியப்படுகின்றன. 112 u நிறையை விட குறைவான நிறை கொண்ட ஐசோடோப்புகள் எலக்ட்ரான் பிடிப்பு என்ற முதன்மை சிதைவு நிலையைக் கொண்டுள்ளன. அணு எண் 47 (வெள்ளி) சிதைவு விளைபொருள் இங்கு ஆதிக்கம் செலுத்துகிறது. கன ஐசோடோப்புகள் பீட்டா உமிழ்வு மூலமாக அணு எண் 49 (இண்டியம்) விளைபொருளாக உருவாகிறது [15].
காட்மியத்தின் 113Cd என்ற ஒரு ஐசோடோப்பு அதிக தேர்ந்தெடுக்கும் திறனுடனும் நியூட்ரான்களை ஈர்க்கிறது. அதிக சாத்தியக் கூறுகளுடன் காட்மியம் துண்டிப்பைக் காட்டிலும் குறைவான ஆற்றல் கொண்ட நியூட்ரான்களும் ஈர்க்கப்படலாம். காட்மியம் துண்டிப்பைக் காட்டிலும் அதிகமான ஆற்றல் கொண்ட நியூட்ரான்கள் கடத்தப்படுகின்றன. 0.5 எலக்ட்ரான் வோல்ட்டு காட்மியம் துண்டிப்பும் அதைவிடக் குறைவான அளவு கொண்ட நியூட்ரான்களும் மெதுவான நியூட்ரான்களாக கருதப்படுகின்றன. இவை வேகமான நியூட்ரான்கள் மற்றும் இடைநிலை நியூட்ரான்கள் ஆகியவற்றிலிருந்து வேறுபட்டவையாகும் [16].
0.6 முதல் 10 சூரிய நிறை கொண்ட குறைவு மற்றும் இடைநிலை நிறை கொண்ட விண்மீன்களில் ஆயிரக்கணக்கான ஆண்டுகளாக எசு செயல்முறை மூலம் காட்மியம் உருவாக்கப்படுகிறது. இச்செயல் முறையில் ஒரு வெள்ளி அணு நியூட்ரானை ஈர்த்து பின்னர் பீட்டா சிதைவுக்கு உள்ளாகிறது [17].
பிரித்தெடுத்தல்
[தொகு]
காட்மியம் பெரும்பாலும் துத்தநாகம் உள்ள கனிமங்களில் கலந்த வேற்றுப்பொருளாக உள்ளது. எனவே துத்தநாகம் எடுக்கும் தொழில்முறையில் இது துணை விளைபொருளாகப் பெறப்படுகின்றது. துத்தநாக சல்பைடு என்னும் மாழைமண் (கனிமம்) ஆக்ஸிஜனுடன் சேர்த்து சூடு செய்து துத்தநாக சல்பைடுதனை துத்தநாக ஆக்ஸைடு ஆக மாற்றப்படுகின்றது. பிறகு கரிமத்துடன் சேர்த்து உலையில் இட்டாலோ, அல்லது கந்தகக் காடியில் மின்வேதியியல் கரைசல் முறையில் துத்தநாகம் பிரித்தெடுக்கப்படுகின்றது. காட்மியத்தை (தூய்மையற்ற) துத்தநாகத்தில் இருந்து எடுக்க, காட்மியம் கலந்த துத்தநாகத்தை வெற்றிடப் படிவு செய்து அதில் இருந்து காட்மியம் பெறப்படுகின்றது. மின்வேதியியல் கரைசல் முறையில், காட்மியம் சல்பேட்டு பிரிவுற்று தங்கி விடுகின்றது[18].
பயன்பாடுகள்
[தொகு]
உலகில் பிரித்தெடுக்கும் காட்மியத்தில் முக்கால் பங்கு நிக்கல்-காட்மியம் மின்கலங்கள் செய்வதற்கும், மீதி கால் பங்கு நிறமிகளாக பல்வேறு பூச்சுகளுக்குப் பயன்படுகின்றது. நெகிழிகளில் நிலைப்படுத்திகளாகவும் (stabilizers) பயன்படுகின்றது. பிற பயன்பாடுகள்:
- உராய்வைக் குறைக்க மென்மையான இப்பொருள் உருள்தாங்கிகளில் (bearing) பயன்படுகின்றது.
- 6% காட்மியம் மின்வேதியியல் (மாழைப்) பூச்சுகளில் பயன்படுகின்றது.
- பல்வேறு ஒட்டு/பற்றுவைப்பு வேலைகலில் ஒட்டுவைப்புப் பொருளாப்பயன்படுகின்றது
- அணு உலையில், அணுப்பிளவுத் தடுல்லுக்கு கட்டுறுத்தும் பொருளாகப் பயன்படுகின்றது.
- காட்மியம் செலினைடு என்னும் சேர்மம் சிவப்பு நிறமியாகவும், சல்பைடுகள் மங்கள் நிறமியாகவும் பயன்படுகின்றது
- காட்மியம் டெலூரைடு என்னும் பொருள் கதிரொளி மின்கலங்களில் பயன்படுகின்றது.
- இரவில் வெப்பத்தை மட்டும் கொண்டு மக்கள்/ஊர்திகள் நட்மாட்டத்தை அறியப் பயன்படும் அகச்சிவப்பு மின்காந்த அலைகளை உணரவல்ல இரவுக்கண்களாக பயன்படுகின்றது. (அகச்சிவப்பு படக்கருவிகள்). இவை பாதரச-காட்மிய-டெலூரைடு அல்லது மெர்க்குரி-காட்மியம்-டெலுரைடு (HgCdTe ) என்னும் கூட்டுக் குறைக்கடத்திப் பொருளால் செய்யப்படும் கருவிகள் ஆகும்.
மேற்கோள்கள்
[தொகு]- ↑ Hermann, C. S. (1818). "Noch ein schreiben über das neue Metall". Annalen der Physik 59 (5): 113–116. doi:10.1002/andp.18180590511. Bibcode: 1818AnP....59..113H. http://gallica.bnf.fr/ark:/12148/bpt6k150680/f125.chemindefer.
- ↑ Waterston, W.; Burton, J. H. (1844). Cyclopædia of commerce, mercantile law, finance, commercial geography and navigation. H. G. Bohn. p. 122.
- ↑ Rowbotham, T.; Rowbotham, T. L. (1850). The Art of Landscape Painting in Water Colours. Windsor and Newton. p. 10.
- ↑ Ayres, R. U.; Ayres, L.; Råde, I. (2003). The Life Cycle of Copper, Its Co-Products and Byproducts. Springer. pp. 135–141. பன்னாட்டுத் தரப்புத்தக எண் 978-1-4020-1552-6.
- ↑ Dunglison, R. (1866). Medical Lexicon: A Dictionary of Medical Science. Henry C. Lea. p. 159.
- ↑ "International Angstrom". Science Dictionary. 2013-09-14. Archived from the original on 2018-11-18. பார்க்கப்பட்ட நாள் 2014-09-24.
- ↑ "angstrom or ångström". Sizes.com. 2010-10-28. பார்க்கப்பட்ட நாள் 2014-09-24.
- ↑ Burdun, G. D. (1958). "On the new determination of the meter". Measurement Techniques 1 (3): 259–264. doi:10.1007/BF00974680.
- ↑ 9.0 9.1 Lansche, A. M. (1956). "Cadmium". Minerals Yearbook, Volume I: Metals and Minerals (Except Fuels). United States Geological Survey. பார்க்கப்பட்ட நாள் 21 April 2008.
- ↑ "USGS Mineral Information: Cadmium". United States Geological Survey. பார்க்கப்பட்ட நாள் 8 August 2009.
- ↑ 11.0 11.1 Holleman, A. F.; Wiberg, E.; Wiberg, Nils (1985). "Cadmium". Lehrbuch der Anorganischen Chemie, 91–100 (in ஜெர்மன்). Walter de Gruyter. pp. 1056–1057. பன்னாட்டுத் தரப்புத்தக எண் 978-3-11-007511-3.
- ↑ "Case Studies in Environmental Medicine (CSEM) Cadmium". Agency for Toxic Substances and Disease Registry. Archived from the original on 6 June 2011. பார்க்கப்பட்ட நாள் 30 May 2011.
- ↑ Cotton, F. A. (1999). "Survey of Transition-Metal Chemistry". Advanced Inorganic Chemistry (6th ed.). John Wiley and Sons. pp. 633. பன்னாட்டுத் தரப்புத்தக எண் 0-471-19957-5.
- ↑ Carballo, Rosa; Castiñeras, Alfonso; Domínguez-Martin, Alicia; García-Santos, Isabel; Niclós-Guttiérrez, Juan (2013). "Chapter 7. Solid state structures of cadmium complexes with relevance to biological systems". In Astrid Sigel; Helmut Sigel; Roland K. O. Sigel (eds.). Cadmium: From Toxicology to Essentiality. Metal Ions in Life Sciences. Vol. 11. Springer. pp. 145–189. எண்ணிம ஆவணச் சுட்டி:10.1007/978-94-007-5179-8_7.
- ↑ 15.0 15.1 Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A. H. (2003). "The NUBASE Evaluation of Nuclear and Decay Properties". Nuclear Physics A 729 (1): 3–128. doi:10.1016/j.nuclphysa.2003.11.001. Bibcode: 2003NuPhA.729....3A. http://hal.in2p3.fr/in2p3-00014184.
- ↑ Knoll, G. F. (2000). Radiation Detection and Measurement. Wiley. p. 505. பன்னாட்டுத் தரப்புத்தக எண் 978-0-471-07338-3.
- ↑ Padmanabhan, T. (2001). "Stellar Nucleosynthesis". Theoretical Astrophysics, Volume II: Stars and Stellar Systems. கேம்பிறிட்ஜ் பல்கலைக்கழகப் பதிப்பகம். pp. 230–236. பன்னாட்டுத் தரப்புத்தக எண் 978-0-521-56631-5.
- ↑ Cadmium at WebElements.com
புற இணைப்புகள்
[தொகு]

