Amino asit
 Vikipedi, özgür ansiklopedi
Vikipedi, özgür ansiklopedi

Amino asitler (bazı kaynaklardaki yazılışıyla aminoasitler), proteinleri oluşturan temel yapı taşlarıdır.
Kimyada bir aminoasit hem amin hem de karboksil fonksiyonel gruplar içeren bir moleküldür. Aminoasitlerin peptit bağlarıyla uç uca eklenmesiyle oluşturdukları kısa polimer zincirler "peptit", uzun polimer zincirler ise "polipeptit" veya "protein" olarak adlandırılırlar. Hücre içerisinde ribozomlar, mRNA moleküllerini kalıp olarak kullanarak amino asitleri uç uca ekleyerek proteinleri sentezlerler. Bu işleme translasyon (okuma) denir.
Bahsedilen amino asitlerin hepsinin aynı anda herhangi bir proteinin yapıtaşında bulunması gerekmez. Ayrıca hepsi eşit miktarda da değildir. Proteinlerde bunlardan çok daha farklı amino asitler de bulunabilir. Proteinlerin toplam amino asit sayısı, içerdiği amino asit çeşidi sayısı ve sıralaması DNA'dan gelen komutlar sayesinde belirlenir. Farklı proteinler, 20 temel amino asitle oluşturulmuş polipeptitlerin daha sonra “farklılaşmaları” ile oluşur. Bu tür amino asit farklılaşmaları, proteinin özelliklerini ve işlevlerini oldukça fazla değiştirir. Örneğin çözünürlüklerini arttırabilir veya azaltabilir ya da diğer molekülerle etkileşmelerini düzenleyebilir.
Amino asitlere ek olarak proteinler, çok daha farklı gruplar da barındırabilirler. Amino asit dışında, yapısında farklı türler barındıran proteinlere, “konjuge proteinler” denir. Konjuge proteinler, kovalent veya kovalent olmayan bağlarla, nükleik asitlerle nükleoproteinleri, lipitlerle lipoproteinleri, karbonhidratlarla glikoproteinleri ve daha birçok küçük molekül kütleli maddelerle, metallerle ve metal içeren gruplarla kompleks yapılar oluşturabilirler. Amino asitler aynı zamanda sadece sitoplazmada üretilirler.[kaynak belirtilmeli]
Yapısı
[değiştir | kaynağı değiştir]Her amino asitin, bir karboksil ve bir de amino grubu vardır. Bu gruplar birbirlerinden α-karbon adı verilen tek bir C atomuyla ayrılırlar. Nötral sulu çözeltilerde α-karboksil grubu bir protonunu kaybeder ve eksi (-) yüklü hale geçer . Aynı şekilde α-amino grubuysa bir elektron kaybederek artı (+) yüklü olur . Amino asitlerin asimetrik merkezleri (kiral karbonları) vardır. Örneğin Glisin'de, amino asitin α-karbonu dört farklı gruba bağlanabilir. Bu sebepten her amino asit D veya L formunda bulunabilir. Ribozomlar üzerinde amino asit sentezinde her zaman L amino asit kullanılır. Sadece mikroorganizmalar, belli küçük peptitlerin sentezinde D amino asitlerini kullanırlar. İlginç bir örnek olarak, Güney Amerika ağaç kurbağasının derisinde sentezlenen bazı peptidler verilebilir. Bu peptidlerde D amino asitleri bulunmuştur. Bu peptitlerden “dermorphin”, sıçan beynindeki opiate reseptörleri (beyindeki uyuşturucu madde reseptörleri) ile etkileşime girerek oldukça güçlü bir ağrı kesici etki göstermiştir. Bu kurbağaların sentezlediği peptitlerdeki D amino asitleri, peptitte daha önceden bulunan L amino asitleri ile birleşerek enzimleri aktive edebilmektedir.
Amino asit yan gruplarının özellikleri
[değiştir | kaynağı değiştir]Polipeptidin ana zinciri, her amino asit için aynı olan grupların birleşimidir. Yan zincir veya R grubu ise, α-karbonuna bağlıdır ve 20 amino asitin her birinde farklıdır. Bu farklılık, proteinin kendine özgü oldukça değişik yapıları ve aktiviteleri kazandırır. Tüm amino asit yan zincirleri bir arada düşünüldüğünde, artı veya eksi yüklüden hidrofobiğe kadar oldukça fazla çeşitli yapısal özellikler gösterirler. Ayrıca bu yan zincirler, oldukça farklı çeşitlilikte kovalent ve nonkovalent bağların yapısına katılabilirler.
Bir enzimin “aktif bölgesi”, birçok farklı organik reaksiyonu katalizleyebilir. Yan zincirlerin çeşitli karakteristiği, molekülün yapısını ve aktivitesini belirleyen molekül içi (intramoleküler) etkileşimlerden, peptitin diğer polipeptitler gibi moleküllerle aralarındaki ilişkiyi belirleleyen moleküller arası etkileşimlere kadar birçok şeyi etkiler.
Apolar aminoasitler
[değiştir | kaynağı değiştir]Apolar aminoasitler, yan zincirlerinde hidrofobik özellik gösteren radikal grup bulundururlar. Elektrostatik bağlar yapamayan amino asitlerdir. Yan zincirlerinde, genellikle oksijen veya azot yoktur. Öncelikli olarak (bir proteindeki özel bir boşluğa hangi amino asitin en iyi şekilde uyabileceğini belirleyen) büyüklük ve şekillerine göre ayrılırlar. Van der Waals kuvvetleri ve hidrofobik etkileşimler sayesinde bir arada tutunurlar.
Prolin bir iminoasittir, yani amino grubu değil imino grup taşır. Bunu kâğıt kromatografisinde farklı renge boyandığından da anlayabiliriz.
Polar yüksüz aminoasitler
[değiştir | kaynağı değiştir]Polar yüksüz aminoasitler, nötral pH'da yüksüzdürler. Bu gruptaki amino asitlerin yan zincirleri zayıf asit ve bazlardır. Fizyolojik pH'da tamamen yüklü değildirler, ancak kısmi artı (+) ve eksi (-) yükler içerirler. Bu sebeple, su da dahil olmak üzere, diğer moleküllerle H-bağı yapabilirler. Genelde oldukça reaktif amino asitlerdir.
Ayrıca, iki Sisteinin disülfit bağı ile birleşmesiyle oluşan dipeptite sistin denir.
Polar asidik aminoasitler
[değiştir | kaynağı değiştir]Polar asidik aminoasitler, fizyolojik pH'da negatif yüklüdürler ve asidik özellik gösterirler.
Polar bazik aminoasitler
[değiştir | kaynağı değiştir]Polar bazik aminoasitler, yan zincirlerinde proton alıcı moleküller taşırlar.
Aminoasitlerin özelliklerini ve standart kodunu gösteren tablo
[değiştir | kaynağı değiştir]| Aminoasit | 3-Harf | 1-Harf | Yan zincir polaritesi | Yan zincir asidite veya bazisite | Hidropati endeksi[1] |
|---|---|---|---|---|---|
| alanin | ala | A | apolar | nötr | 1.8 |
| arjinin | arg | R | polar | kuvvetli bazik | -4.5 |
| asparajin | asn | N | polar | nötr | -3.5 |
| aspartik asit | asp | D | polar | asidik | -3.5 |
| sistein | cys | C | polar | nötr | 2.5 |
| glütamik asit | glu | E | polar | asidik | -3.111 |
| glütamin | gln | Q | polar | nötr | -3.5 |
| glisin | gly | G | apolar | nötr | -.4 |
| histidin | his | H | polar | hafif bazik | -3.2 |
| izolösin | ile | I | apolar | nötr | 4.5 |
| lösin | leu | L | apolar | nötr | 3.8 |
| lizin | lys | K | polar | bazik | -3.9 |
| metiyonin | met | M | apolar | nötr | 1.9 |
| fenilalanin | phe | F | apolar | nötr | 2.8 |
| prolin | pro | P | apolar | nötr | |
| serin | ser | S | polar | nötr | -.8 |
| treonin | thr | T | polar | nötr | -.7 |
| triptofan | trp | W | apolar | nötr | -.9 |
| tirozin | tyr | Y | polar | nötr | -1.3 |
| valin | val | V | apolar | nötr | 4.2 |
Yukarıdaki tabloda gösterilen 3-harfli ve 1-harfli aminoasit koduna ek olarak, kimyasal veya kristalografik analizler sonucunda bir proteinin belli bir pozisyonundaki aminoasit kesin olarak belirlenemediğinde, aşağıdaki tablodaki kısaltmalar da kullanılabilmektedir.
| Dejeneresite kodu | 3-Harf | 1-Harf |
|---|---|---|
| asparajin veya aspartat | asx | B |
| glütamin veya glütamat | glx | Z |
| herhangi bir veya bilinmeyen | unk | X |
Besin maddesi olarak aminoasitler
[değiştir | kaynağı değiştir]Proteinlerin yapısını oluşturan 20 çeşit amino asit arasında 10 tanesi temel amino asitler olarak adlandırılır. Bu amino asitler insan vücudu tarafından ihtiyacı karşılayacak düzeyde sentezlenemedikleri için dışarıdan beslenme yoluyla alımları zorunludur. Sistein, tirozin, histidin ve arjinin çocuklar için yarı zaruri aminoasitler olarak kabul edilmektedirler çünkü bunların sentezlenmesini yürüten metabolik reaksiyonlar çocuklarda tam olarak gelişmemiştir.[2]
| Temel aminoasitler | Diğerleri |
|---|---|
| İzolösin | Alanin |
| Lösin | Asparajin |
| Lizin | Aspartik asit |
| Metionin | Sistein |
| Fenilalanin | Glutamik asit |
| Treonin | Glutamin |
| Triptofan | Glisin |
| Valin | Prolin |
| Arjinin* | Serin |
| Histidin* | Tirozin |
(*) Sadece özel durumlarda beslenme açısından dışarıdan alımı zaruridir. (Yenidoğanlarda ve üremili hastalarda)
Özellikler
[değiştir | kaynağı değiştir]- Prolin eskiden ikinci amin grubu yüzünden iminoasitler altında inceleniyordu, fakat bu tanımlama eskimiştir.[3] Artık non.esensiyel glutamik asitten oluşan bir aminoasit olarak değerlendirilmektedir.[4]
- Histidin kanda tamponlama görevinde kullanılır.
- Tirozin; vücudun rengini veren melanin pigmentinin yapımında, katekolaminlerin sentezinde kullanılır.
- Triptofan serotonin sentezinde rol oynar.
- Aspartat üre döngüsünde ürenin azotlarından birine kaynaklık eder.
- Glütamin toksik amonyağın toksik olmayan depo şeklidir.
- Protein yapısına sadece L-alfa amino asitler katılır.
- Glisin en küçük ve en iyi sığan amino asittir.
- Metiyonin Metilasyon reaksiyonlarında metil vericisidir.
- Komşu 2 sistein aminoasitleri arasında disülfit bağı oluşur.
Strecker amino asit sentezi
[değiştir | kaynağı değiştir]Adolph Strecker tarafından bulunan Strecker amino asit sentezi bir aldehit (ya da keton)dan bir dizi kimyasal reaksiyonla bir amino asit sentezlenmesidir.[5][6][7] Aldehit potasyum siyanür eşliğinde amonyum klorür ile bir α-aminonitril oluşturacak şekilde reaksiyona sokulur. Daha sonra bu α-aminonitril hidrolize edilerek istenilen amino asit elde edilir.[8][9] Orijinal Strecker reaksiyonunda asetaldehit, amonyak ve hidrojen siyanür ün verdiği reaksiyon ürünü, hidrolizlenerek alanin elde edilmiştir.
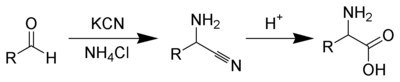
Amonyum tuzlarının kullanımı ornatılmamış amino asitleri verirken, primer ve sekonder aminlerin kullanımı da ornatılmış amino asitleri verir. Aynı şekilde, aldehitlerin yerine ketonların kullanımı α,α-disubstitüe amino asitleri verir.[10]
Adolph Strecker'in 1850 yılından beri uygulanan geleneksel sentezi rasemik α-amino nitrilleri verir iken son zamanlarda asimetrik yardımcı maddeler[11] ya da asimetrik katalizörler[12][13] kullanılarak değişik yöntemler geliştirilmiştir.[14]
Kullanım alanı
[değiştir | kaynağı değiştir]Strecker sentezinin günümüzde kullanıldığı bir örnek 3-metil-2-bütanon'dan başlayarak bir L-valin türevinin çok miktarda sentezlenmesidir:[15][16]
Kaynakça
[değiştir | kaynağı değiştir]- Lippincott Illustrated Reviews Biochemistry
- Harper's Biochemistry
- S. Karp, Molecular Biology and Cell, Wiley & Sons., 1998.
- D. L. Nelson, M. M. Cox, Lehninger Principles of Biochemistry, Freeman and Co., 2005.
Özel kaynakça
[değiştir | kaynağı değiştir]- ^ Kyte J & RF Doolittle (1982). "A simple method for displaying the hydropathic character of a protein". J. Mol. Biol., 157. ss. 105-132. PMID 7108955.
- ^ Imura K, Okada A (1998). "Amino acid metabolism in pediatric patients". Nutrition. 14 (1). ss. 143-8. PMID 9437700.
- ^ "IUPAC - imino acids (I02959)". goldbook.iupac.org. 21 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2020.
- ^ "MeSH Browser". meshb.nlm.nih.gov. 21 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Kasım 2020.
- ^ Strecker, A. (1850). "Ueber die künstliche Bildung der Milchsäure und einen neuen, dem Glycocoll homologen Körper". Annalen der Chemie und Pharmazie. 75 (1). ss. 27-45. doi:10.1002/jlac.18500750103.
- ^ Strecker, A. (1854). "Ueber einen neuen aus Aldehyd - Ammoniak und Blausäure entstehenden Körper (p )". Annalen der Chemie und Pharmazie. 91 (3). ss. 349-351. doi:10.1002/jlac.18540910309.
- ^ Shibasaki, M.; Kanai, M.; Mita, K. Org. React. 2008, 70, 1. DOI:10.1002/0471264180.or070.01
- ^ Kendall, E. C.; McKenzie, B. F. Organic Syntheses, Coll. Vol. 1, p.21 (1941); Vol. 9, p.4 (1929). (Article 28 Temmuz 2012 tarihinde Wayback Machine sitesinde arşivlendi.)
- ^ Clarke, H. T.; Bean, H. J. Organic Syntheses, Coll. Vol. 2, p.29 (1943); Vol. 11, p.4 (1931). (Article 28 Temmuz 2012 tarihinde Wayback Machine sitesinde arşivlendi.)
- ^ Masumoto, S.; Usuda, H.; Suzuki, M.; Kanai, M.; Shibasaki, M. J. Am. Chem. Soc. 2003, 125(19), 5634-5635. (DOI:10.1021/ja034980+)
- ^ Davis, F. A. et al. Tetrahedron Lett. 1994, 35, 9351.
- ^ Ishitani, H.; Komiyama, S.; Hasegawa, Y.; Kobayashi, S. J. Am. Chem. Soc. 2000, 122(5), 762-766. (DOI:10.1021/ja9935207)
- ^ Huang, J.; Corey, E. J. Org. Lett. 2004, 6(26), 5027-5029. (DOI:10.1021/ol047698w)
- ^ Duthaler, R. O. Tetrahedron 1994, 50, 1539-1650. (Review, DOI:10.1016/S0040-4020(01)80840-1)
- ^ A Concise Synthesis of (S)-N-Ethoxycarbonyl--methylvaline Jeffrey T. Kuethe, Donald R. Gauthier, Jr., Gregory L. Beutner, and Nobuyoshi Yasuda J. Org. Chem., 72 (19), 7469 -7472, 2007. DOI:10.1021/jo7012862
- ^ Sodyum siyanür ve amonyak ile yapılan 3-metil-2bütanon’un başlangıç reaksiyon ürünü L-tartarik asit uygulaması ile çözümlenmiştir. Amino asit disiklohekzilamin tuzu olarak ayrılır.


